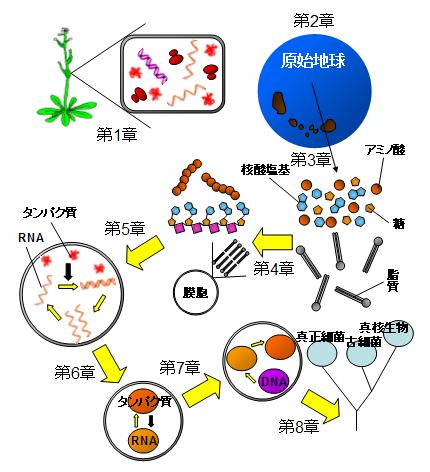
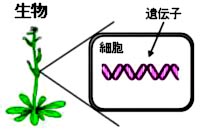
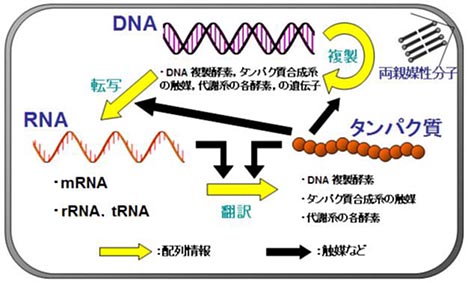
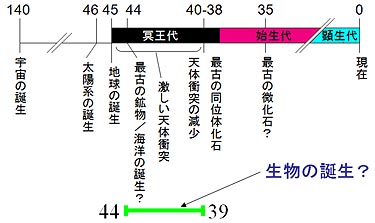
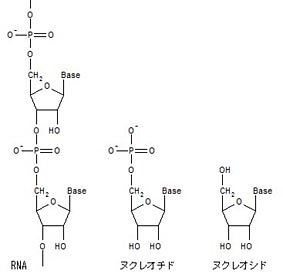
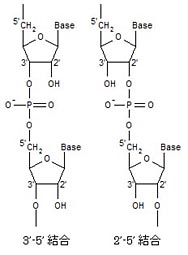
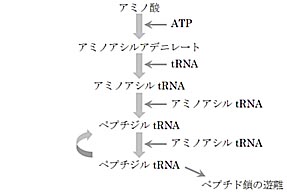
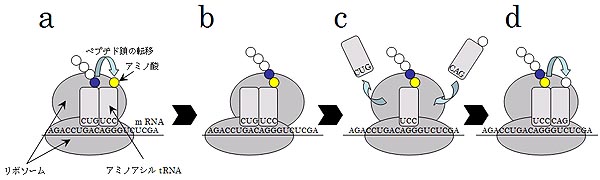
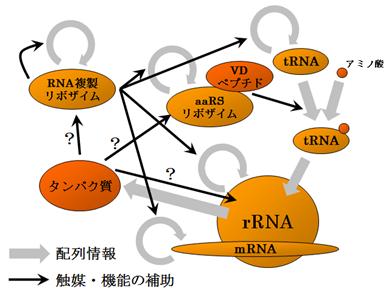
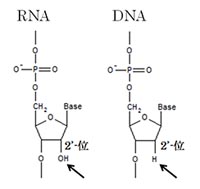
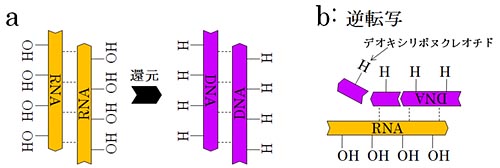
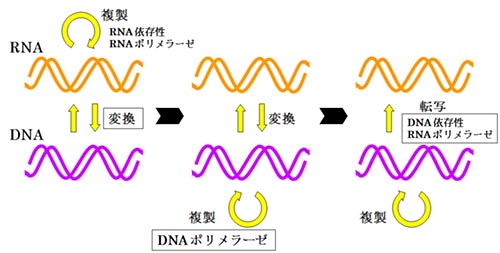
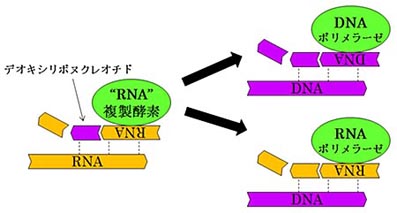
Allègre, C. J., Manhès, G. & Göpel, C. The age of the Earth. Geochim. Cosmochim. Acta 59,
1445-1456 (1995).
Allwood, A. C., Walter, M. R., Kamber, B. S., Marshall, C. P. & Burch, I. W.
Stromatolite reef from the Early Archaean era of Australia. Nature 441, 714-718 (2006).
Amelin, Y. A tale of early Earth told in zircons. Science 310, 1914-1915 (2005).
Amelin, Y., Krot, A. N., Hutcheon, I. D. & Ulyanov, A. A. Lead isotopic ages of chondrules and calcium-aluminum-rich
inclusions. Science 297, 1678-1683 (2002).
Anders, E. Pre-biotic organic matter from comets and asteroids. Nature 342, 255-257 (1989).
Arrhenius, G. & Lepland, A. Accretion of Moon and Earth and the emergence of life. Chem. Geol. 169, 69-82
(2000).
Bachmann, P. A., Luisi, P. L. & Lang, J. Autocatalytic self-replicating micells as models for prebiotic structures.
Nature 357, 57-59 (1992).
Bada, J. L., Bigham, C. & Miller, S. L. Impact melting of frozen oceans on the early Earth:
Implications for the origin of life. Proc. Natl. Acad. Sci. USA 91, 1248-1250 (1994).
Baldauf, S. L., Palmer, J. D. & Doolittle, W. F. The root of the universal tree and the origin of eukaryotes based on elongation factor phylogeny.
Proc. Natl. Acad. Sci. USA 93, 7749-7754 (1996).
Barns, S. M., Delwiche, C. F., Palmer, J. D. & Pace, N. R. Perspectives on archaeal phylogeny, thermophily and monophyly
from environmental rRNA sequences. Proc. Natl. Acad. Sci. USA 93, 9188-9193 (1996).
Bar-Nun, A. & Chang, S. Photochemical reactions of water and carbon monoxide in Earth's primitive atmosphere.
Geophys. Res. 88, 6662-6672 (1983).
Bartel, D. P. & Szostak, J. W. Isolation of new ribozymes from a large pool of random sequences.
Science 261, 1411-1418 (1993).
Battistuzzi, F. U., Feijao, A. & Hedges, S. B. A genomic timescale of prokaryote evolution: Insights into the origin of
methanogenesis, phototrophy, and the colonization of land. BMC Evol. Biol. 4, 44 (2004).
Baymann, F. et al. The redox protein construction kit: Pre-last universal common ancestor evolution of energy-conserving enzymes.
Phil. Trans. R. Soc. Lond. B 358, 267-274 (2003).
Bennett, C. L. et al. First-year Wilkinson Microwave Anisotropy Probe (WMAP) observations: preliminary
maps and basic results. Astrophys. J. Suppl. 148, 1-27 (2003).
Bernstein, M. P., Dworkin, J. P., Sandford, S. A., Cooper, G. W. & Allamandola, L. J. Racemic amino acids
from the ultraviolet photolysis of interstellar ice analogues. Nature 416, 401-403 (2002).
Bernstein, M. P., Sandford, S. A. & Allamandola, L. J. Life's far-flung raw materials.
Sci. Am. 281(1) 42-49 (1999).
Bolli, M., Micura, R. & Eschenmoser, A. Pyranosyl-RNA: Chiroselective self-assembly of base sequences
by ligative oligomerization of tetranucleotide-2',3'-cyclophosphates (with a commentary concerning the origin of
biomolecular homochirality). Chem. Biol. 4, 309-320 (1997).
Bowring, S. A., Williams, I. S. & Compston, W. 3.96 Ga gneisses from the Slave province, Northwest Territories,
Canada. Geology 17, 971-975 (1989).
Bowring, S. A. & Williams, I. S. Priscoan (4.00-4.03 Ga) orthogneisses from northwestern Canada. Contrib. Mineral. Petrol.
134, 3-16 (1999).
Brasier, M. D. et al. Questioning the evidence for Earth's oldest fossils. Nature 416, 76-81 (2002).
Brasier, M., Green, O., Lindsay, J. & Steele, A. Earth's oldest (∼ 3.5 Ga) fossils and the ‘Early Eden
hypothesis’: questioning the evidence. Orig. Life Evol. Biosph. 34, 257-269 (2004).
Brasier, M., McLoughlin, N., Green, O. & Wacey, D. A fresh look at the fossil evidence for early Archaean cellular life.
Phil. Trans. R. Soc. B. 361, 887-902 (2006).
Brochier, C. & Philippe, H. A non-hyperthermophilic ancestor for Bacteria. Nature 416, 76-81 (2002).
Cairns-Smith, A. G., Ingram, P. & Walker, G. L. Formose production by minerals: Possible relevance to the origin of life.
J. Theor. Biol. 35, 601-604 (1972).
Carlton, J. M. Draft genome sequence of the sexually transmitted pathogen Trichomonas vaginalis.
Science 315, 207-212 (2007).
Catling, D. C. Comment on "a hydrogen-rich early Earth atmosphere. Science 311, 38a (2006).
Cavalier-Smith, T. The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial
megaclassification. Int. J. Syst. Evol. Microbiol. 52, 7-76 (2002a).
Cavalier-Smith, T. The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa. Int. J. Syst. Evol. Microbiol.
52, 297-354 (2002b).
Chyba, C. F. The violent environment of the origin of life: Progress and uncertainties.
Geochim. Cosmochim. Acta 57, 3351-3358 (1993).
Chyba, C. F. Rethinking Earth's early atmosphere. Science 308, 962-963 (2005).
Chyba, C. & Sagan, C. Endogenous production, exogenous delivery and impact-shock synthesis of organic molecules:
An inventory for the origins of life. Nature 355, 125-132 (1992).
Cleland, C. E. & Chyba, C. F. Defining life. Orig. Life Evol. Biosph. 32, 387-393 (2002).
Cohen, B. A., Swindle, T. D. & Kring, D. A. Support for the lunar cataclysm hypothesis from lunar meteorite impact melt ages.
Science 290, 1754-1756 (2000).
Cooper, G. et al. Carbonaceous meteorites as a source of sugar-related organic compounds for the early Earth.
Nature 414, 879-883 (2001).
Crick, F. H. C. & Orgel, L. E. Directed Panspermia. Icarus 19, 341-346 (1973).
Cronin, J. R. in The Molecular Origins of Life (ed Brack, A.) 119-146 (Cambridge University Press, Cambridge, 1998).
Cronin, J. R. & Pizzarello, S. Enantiometric excesses in meteoritic amino acids. Science 275, 951-955 (1997).
Culler, T. S., Becker, T. A., Muller, R. A. & Renne, P. R. Lunar impact history from 40Ar/39Ar dating
of glass spherules. Science 287, 1785-1788 (2000).
Dauphas, N. The U/Th production ratio and the age of the Milky Way from meteorites and Galactic halo stars.
Nature 435, 1203-1205 (2005).
Deamer, D. W. Boundary structures are formed by organic components of the Murchison carbonaceous chondrite.
Nature 317, 792-794 (1985).
Deamer, D. W. in The Molecular Origins of Life (ed Brack, A.) 189-205 (Cambridge University Press, Cambridge, 1998).
Deamer, D. W. & Pashley, R. M. Amphiphilic components of the Murchison carbonaceous chondrite:
Surface properties and membrane formation. Orig. Life Evol. Biosph. 19, 21-38 (1989).
De Graaf R. M., Visscher, J. & Schwartz, A. W. Reactive phophonic acids as prebiotic carriers of phosphorus.
J. Mol. Evol. 44, 237-241 (1997).
De Gregorio, B. T. & Sharp, T. G. Determining the biogenicity of microgossils in the Apex chert, Western Australia, using
transmission electron microscopy. Lunar Planet. Sci. XXXIV 1267 (2003).
Delsemme, A. H. in The Molecular Origins of Life (ed Brack, A.) 100-118 (Cambridge University Press, Cambridge, 1998).
Dolezal, P. et al. Giardia mitosomes and trichomonad hydrogenosomes share a common mode of protein targeting.
Proc. Natl. Acad. Sci. USA 102, 10924-10929 (2005).
Doolittle, W. F. Phylogenetic classification and the universal tree. Science 284, 2124-2129 (1999).
Doudna, J. A. & Szostak, J. W. RNA-catalysed synthesis of complementary-strand RNA.
Nature 339, 519-522 (1989).
Doudna, J. A., Couture, S. & Szostak, J. W. A multisubunit ribozyme that is a catalyst of and template for complementary strand
RNA synthesis. Science 251, 1605-1608 (1991).
Dworkin, J. P., Deamer, D. W., Sandford, S. A. & Allamandola, L. F. Self-assembling amphiphilic molecules:
Synthesis in simulated interstellar/precometary ices. Proc. Natl. Acad. Sci. USA 98, 815-819 (2001).
Eiler, J. M. The oldest fossil or just another rock? Science 317, 1046-1047 (2007).
Ekland, E. H. & Bartel, D. P. RNA-catalysed RNA polymerization using nucleoside triphosphates. Nature 382,
373-376 (1996).
Ekland, E. H., Szostak, J. W. & Bartel, D. P. Structurally complex and highly active RNA ligases derived
from random RNA sequences. Science 269, 364-370 (1995).
Embley, T. M. & Martin, W. Eukaryotic evolution, changes and challenges. Nature 440, 623-630 (2006).
Eschenmoser, A. Chemical etiology of nucleic acid structure. Science 284, 2118-2124 (1999).
Fedo, C. M. & Whitehouse, M. J. Metasomatic origin of quartz-pyroxene rock, Akilia, Greenland, and implications for Earth's
earliest life. Science 296, 1448-1452 (2002a).
Fedo, C. M. & Whitehouse, M. J. Origin and significance of Archean quartzose rocks at Akilia, Greenland. Science
298, 917a (2002b).
Feng, D.-F., Cho, G. & Doolittle, R. F. Determining divergence times with a protein clock: Update and reevaluation.
Proc. Natl. Acad. Sci. 94, 13028-13033 (1997).
Ferris, J. P. Montmorillonite-catalysed formation of RNA oligomers: The possible role of catalysis in the origins of life.
Phil. Trans. R. Soc. B 361, 1777-1786 (2006).
Ferris, J. P., Sanchez, R. A. & Orgel, L. E. Studies in prebiotic synthesis III. Synthesis of pyrimidines from cyanoacetylene
and cyanate. J. Mol. Biol. 33, 693-704 (1968).
Ferris, J. P., Hill Jr, A. R., Liu, R. & Orgel, L. E. Synthesis of long prebiotic oligomers on mineral surfaces.
Nature 381, 59-61 (1996).
Frank, F. C. On spontaneous asymmetric synthesis. Biochim. Biophys. Acta 11, 459-463 (1953).
Friend, C. R. L., Nutman, A. P. & Bennett, V. C. Origin and significance of Archean quartzose rocks at Akilia, Greenland.
Science 298, 917a (2002).
Fuller, W. D., Sanchez, R. A. & Orgel, L. E. Studies in previotic synthesis: VI. Synthesis os purine nucleosides.
J. Mol. Biol. 67, 25-33 (1972).
Furnes, H., Barnerjee, N. R., Muehlenbachs, K., Staudigel, H. & de Wit, M. Early life recorded in Archean pillow lavas.
Science 304, 578-581 (2004).
Futamura, Y. & Yamamoto, K. Hydrothermal synthesis of oligoglycines with adiabatic expansion cooling.
Viva Origino 33, 269-274 (2005).
Gabel, N. W. & Ponnamperuma, C. Model for origin of monosaccharides. Nature 216, 453-455 (1967).
Galer, S. J. G. Interrelationships between continental freeboard, tectonics and mantle temperature. Earth Planet. Sci. Lett.
105, 214-228 (1991).
Galtier, N., Tourasse, N. & Gouy, M. A nonhyperthermophilic common ancestor to extant life forms.
Science 283, 220-221 (1999).
Gao, B. & Gupta, R. S. Phylogenomic analysis of proteins that are distinctive of Archaea
and its main subgroups and the origin of methanogenesis. BMC Genomics 8 86 (2007).
Garcia-Ruiz, J. M. et al. Self-assembled silica-carbonate structures and detection of ancient microfossils.
Science 302, 1194-1197 (2003).
Gaucher, E., Thomson, J. M., Burgan, M. F. & Benner, S. A. Inferring the palaeoenvironment of ancient bacteria
on the basis of resurrected proteins. Nature 425, 285-288 (2003).
Gibson, Jr., E. K. et al. Observation and analysis of in situ carbonaceous matter in Naklha: Part II.
Lunar Planet. Sci. XXXVII, 2039 (2006).
Gilbert, W. The RNA world. Nature 319, 618 (1986).
Glikson, A. Comment on "zircon thermometer reveals minimum melting conditions on earliest Earth" I.
Science 311, 779a (2006).
Gogarten, J. P. et al. Evolution of the vacuolar H+-ATPase: Implications for the origin of eukaryotes.
Proc. Natl. Acad. Sci. USA 86, 6661-6665 (1989).
Gomes, R., Levison, H. F., Tsiganis, K. & Morbidelli, A. Origin of the cataclysmic Late Heavy Bombardment period
of the terrestrial planets. Nature 435, 466-469 (2005).
Green, R. & Szostak, J. W. Selection of a ribozyme that function as a superior template in a self-copying reaction.
Science 258, 1910-1915 (1992).
Gribaldo, S. & Brochier-Armanet, C. The origin and evolution of Archaea: A state of the art.
Philos. Trans. R. Soc. Lond., B, Biol. Sci. 361, 1007-1022 (2006).
Gupta, R. S. Evolutionary relationships among photosynthetic bacteria. Photosynth. Res. 76, 173-183 (2003).
Gupta, R. S. & Griffiths, E. Critical issues in bacterial phylogeny. Theor. Popul. Biol. 61, 423-434 (2002).
Hahn, J. When giants roamed. Nature 435, 432-433 (2005).
Haraguchi, H. Multielement profiling analyses of biological, geochemical, and environmental samples as studied by analytical
atomic spectrometry. Bull. Chem. Soc. Jpn. 72, 1163-1186 (1999).
Haraguchi, H. Metallomics as integrated biometal science. J. Anal. At. Spectrom. 19, 5-14 (2004).
Harrison, T. M. et al. Heterogeneous Hadean hafnium: Evidence of continental crust at 4.4 to 4.5 Ga.
Science 310, 1947-1950 (2005).
Hedges, S. B. & Kumar, S. Genomic clocks and evolutionary timescales. Trends Genet. 19, 200-206 (2003).
Hennet, R. J.-C., Holm, N. G. & Engel, M. H. Abiotic synthesis of amino acids under hydrothermal conditions and the origin of life:
A perpetual phenomenon? Naturwissenschaften 79, 361-365 (1992).
Hohn, M. J., Park, H.-S., O'Donoghue, P., Schnitzbauer, M. & Söll, D. Emergence of the universal genetic code imprinted
in an RNA world. Proc. Natl. Acad. Sci. USA 103, 18095-18100 (2006).
Holland, H. D. & Kasting, J. F. in The Proterozoic Biosphere: a Multidisciplinary Study
(eds Schopf, J. W. & Klein, C.) 21-24 (Cambridge University Press, Cambridge, 1992).
Holm, N. G. & Andersson, E. M. in The Molecular Origins of Life (ed Brack, A.) 86-99
(Cambridge University Press, Cambridge, 1998).
Huber, C., Eisenreich, W., Hecht, S. & Wächtershäuser, G. A possible primordial peptide cycle.
Science 301, 938-940 (2003).
Huber, C. & Wächtershäuser, G. α-hydroxy and α-amino acids under possible Hadean,
volcanic origin-of-life conditions. Science 314, 630-632 (2006).
�r������ �����̋N���ɂ��Ă� RNA ���[���h�����͐��������H�i�����̓^���p�N�����[���h���琶�܂ꂽ�I�j
�����Ȋw 51, 43-53 (1999).
Ikehara, K. Origins of gene, genetic code, protein and life. Viva Origino 29, 66-85 (2001).
�r������ GADV �����\�����N����₢���� (���s��w�o�ʼn�, ���s, 2006).
Imai, E., Honda, H., Hatori, K., Brack, A. & Matsuno, K. Elongation of oligopeptides in a simulated submarine hydrothermal system.
Science 283, 831-833 (1999).
���s�Y �ق� �g35���N�O�ŌÃX�g���}�g���C�g�h�̐��́[���I�[�X�g�����A�C�s���o���Y�C���Ñ㒆���C��̔M�����͐ϕ��[
�����n�� 17, 476-481 (1995).
Ito, M., Handa, N. & Yanagawa, H. Architecture of models for prebiotic synthesis of proteins: The structure and function of
polypeptides synthesized in a fluctuating system. Orig. Life 16, 494-495 (1986).
Iwabe, N., Kuma, K., Hasegawa, M., Osawa, S. & Miyata, T. Evolutionary relationship of archaebacteria, eubacteria, and eukaryotes inferred
from phylogenetic trees of duplicated genes. Proc. Natl. Acad. Sci. USA 86, 9355-9359 (1989).
Jacobsen, S. B. How old is planet Earth? Science 300, 1513-1514 (2003).
James, K. D. & Ellington, A. D. The fidelity of template-directed oligonucleotide ligation and the inevitability of
polymerase function. Orig. Life Evol. Biosph. 29, 375-390 (1999).
Johnston, W. K., Unrau, P. J., Lawrence, M. S., Glasner, M. E. & Bartel, D. P. RNA-catalysed RNA polymerization:
Accurate and general RNA-templated primer extension. Science 292, 1319-1325 (2001).
Joyce, G. in Origins of Life: the Central Concepts (eds Deamer, D. W. & Fleischaker, G. R.) xi-xii
(Jones and Bartlett, Boston, 1994).
Joyce, G. F. The antiquity of RNA-based evolution. Nature 418, 214-221 (2002a).
Joyce, G. F. Booting up life. Nature 420, 278-279 (2002b).
Joyce, G. F., Schwartz, A. W., Miller, S. L. & Orgel, L. E. The case for an ancestral genetic system involving simple analogues
of the nucleotides. Proc. Natl. Acad. Sci. USA 84, 4398-4402 (1987).
Karhu, J. & Epstein, S. The implication of the oxygen isotope records in coexisting cherts and phosphates.
Geochim. Cosmochim. Acta 50, 1745-1756 (1986).
Kasamatsu, T., Kaneko, T., Saito, T. & Kobayashi, K. Formation of organic compounds in simulated interstellar media
with high energy particles. Bull. Chem. Soc. Jpn. 70, 1021-1026 (1997).
Kasting, J. F. Earth�'s early Atmosphere. Science 259, 920-926 (1993).
Kasting, J. F. & Brown, L. L. in The Molecular Origins of Life (ed Brack, A.) 35-56
(Cambridge University Press, Cambridge, 1998).
���a�� �����ƒn���̋��i�� (���{�����o�ŋ���, ����, 2000).
Kawamura, K. & Kuranoue, K. Influence of 20 common amino acids on the template-directed formation of
oligoguanylate from guanosine 5'-monophosphate 2-methylimidazolide on a polycytidylic acid template.
Viva Orig. 31, 188-200 (2005).
Kawamura, K., Kuranoue, K. & Umehara, M. Chemical evolution of RNA monomers and RNA polymerases: Implications from search
for the prebiotic pathway of formation of RNA from adenosine 5'-triphosphate in the presence of thermal condensation products
of amino acids as primitive enzymes. Viva Orig. 30, 123-134 (2002).
Kazmierczak, J. & Kremer, B. Thermal alteration of the Earth's oldest fossils. Nature 420, 477-478 (2002).
Kerr, R. A. New signs of ancient life in another martian mateorite. Science 311, 1858-1859 (2006).
Khaitovich, P., Tenson, T., Mankin, A. S. & Green, R. Peptidyl transferase activity catalyzed by protein-free 23S ribosomal RNA
remains elusive. RNA 5, 605-608 (1999).
Kleine, T., Münker, C., Mezger, K. & Palme, H. Rapid accretion and early core formation on asteroids and the terrestrial
planets from Hf-W chronometry. Nature 418, 952-955 (2002).
Klenk, H.-P., Palm, P., Lottspeich, F. & Zillig, W. Component H of the DNA-dependent RNA polymerases of Archaea is homologous to a subunit
shared by the three eucaryal nuclear RNA polymerases. Proc. Natl. Acad. Sci. USA 89, 407-410 (1992).
Klenk, H.-P. et al. RNA polymerase of Aquifex pyrophilus: Implications for the evolution of the bacterial rpoBC operon
and extremely thermophilic bacteria. J. Mol. Evol. 48, 528-541 (1999).
Kleppe, K., van de Sande, J. H. & Khorana, H. G. Polynucleotide ligase-catalyzed joining of deoxyribo-oligonucleotides
on ribopolynucleotide templates and of ribo-oligonucleotides on deoxyribopolynucleotide templates.
Proc. Natl. Acad. Sci. USA 67, 68-73 (1970).
Knight, R. D., Freeland, S. J. & Landweber, L. F. Selection, history and chemisry: The three faces of the genetic code.
Trends Biochem. Sci. 24, 241-247 (1999).
Knoll, A. Life on a Young Planet (Princeton University Press, Princeton, 2003).
Kobayashi, K., Kaneko, T. & Saito, T. Characterization of complex organic compounds formed in simulated planetary atmospheres
by the action of high energy particles. Adv. Space Res. 24, 461-464 (1999).
Kobayashi, K., Kaneko, T., Saito, T. & Oshima, T. Amino acid formation in gas mixtures by high energy particle irradiation.
Orig. Life Evol. Biosph. 28, 155-165 (1998).
Kobayashi, K. & Tsuji, T. Abiotic synthesis of uracil from carbon monoxide, nitrogen and water by proton irradiation.
Chem. Lett. 26, 903-904 (1997).
�����V���� �� ���ȔN�\���� 12 �N (�ۑP, ����, 1999).
Koonin, E. V. Comparative genomics, minimal gene-sets and the last universal common ancestor. Nat. Rev. Microbiol. 1,
127-136 (2003).
Koshland Jr., D. E. The seven pillars of life. Science 295, 2215-2216 (2002).
Krauss, L. M. & Chaboyer, B. Age estimates of globular clusters in the milky way: constraints on cosmology. Science
299, 65-69 (2003).
Kyrpides, N., Overbeek, R. & Ouzounis, C. Universal protein families and the functional content of the last universal common ancestor.
J. Mol. Evol. 49, 413-423 (1999).
Lake, J. A., Henderson, E., Oakes, M. & Clark, M. W. Eocytes: A new ribosome structure indicates a kingdom with a close relationship
to eukaryotes. Proc. Natl. Acad. Sci. USA 81, 3786-3790 (1984).
Larralde, R., Robertson, M. P. & Miller, S. L. Rates of decomposition of ribose and other sugars: Implications
for chemical evolution. Proc. Natl. Acad. Sci. USA 92, 8158-8160 (1995).
Lee, N., Bessho, Y., Wei, K., Szostak, J. W. & Suga, H. Ribozyme-catalyzed tRNA aminoacylation. Nat. Struct. Biol.
7, 28-33 (2000).
Leman, L., Orgel, L. & Ghadiri, M. R. Carbonyl sulfide-mediated prebiotic formation of peptides. Science 306,
283-286 (2004).
Lepland, A., van Zuilen, M. A., Arrhenius, G., Whitehouse, M. J. & Fedo, C. M. Questioning the evidence
for Earth's earliest life - Akilia revisited. Geology 33, 77-79 (2005).
Line, M. A. A hypothetical pathway from the RNA to the DNA world. Orig. Life Evol. Biosph. 35, 395-400 (2005).
Lohrmann, R. & Orgel, L. E. Prebiotic synthesis: Phosphorylation in aqueous solution. Science 161, 64-66
(1968).
Lohrmann, R. & Orgel, L. E. Prebiotic activation processes. Nature 244, 418-420 (1973).
Lowe, D. R. in The Proterozoic Biosphere: a Multidisciplinary Study (eds Schopf, J. W. & Klein, C.) 67-75
(Cambridge University Press, Cambridge, 1992).
Luisi, P. L. About various definitions of life. Orig. Life Evol. Biosph. 28, 613-622 (1998).
Maher, K. A. & Stevenson, D. J. Impact frustration of the origin of life. Nature 331, 612-614 (1988).
Maizels, N. & Weiner, A. M. in The RNA World 2nd ed. (eds Gesteland, R. F., Cech, T. R. & Atkins, J. F.)
79-111 (Cold Spring Harbor Laboratory Press, New York, 1999).
Malin, M. C. & Edgett, K. S. Evidence for persistent flow and aqueous sedimentation on early Mars. Science
302, 1931-1934 (2003).
Marshall, W. L. Hydrothermal synthesis of amino acids. Geochim. Cosmochim. Acta 58, 2099-2106 (1994).
�ێR�Γ� ����� ���s�Y �����ƒn���̗��j (��g���X, ����, 1998).
Matsui, T. & Abe, Y. Evolution of an impact-induced atmosphere and magma ocean on the accreting Earth.
Nature 319, 303-305 (1986).
Matsui, T. & Mizutani, H. Why is a minor planet minor? Nature 270, 506-507 (1977).
Maurette, M. in The Molecular Origins of Life (ed Brack, A.) 147-186 (Cambridge University Press, Cambridge, 1998).
Mautner, M. N., Leonard, R. L. & Deamer, D. W. Meteorite organics in planetary environments: Hydrothermal release,
surface activity, and microbial utilization. Planet. Space Sci. 43, 139-147 (1995).
McBride, J. M. & Tully, J. C. Did life grind to a start? Nature 452, 161-162 (2008).
McKay, C. P. et al. Search for past life on Mars: possible relic biogenic activity in martian meteorite ALH84001.
Science 273, 924-930 (1996).
McKay, C. P. in The Molecular Origins of Life: Assembling Pieces of the Puzzle (eds Brack, A.) 386-406
(Cambridge University Press, Cambridge, 1998).
McKay, D. S. et al. Observation and analysis of in situ carbonaceous matter in Nakhla: Part I. Lunar Planet. Sci.
XXXVII, 2251 (2006).
McKeegan, K. D., Kudryavtsev, A. B. & Schopf, J. W. Raman and ion microscopic imagery of graphitic inclusions in apatite
from older than 3830 Ma Akilia supracrustal rocks, west Greenland. Geology 35, 591-594 (2007).
Millero, F. J. Chemical Oceanography 3rd. ed. (Taylor & Francis, Boca Raton, 2006).
Miller, S. L. A production of amino acids under possible primitive earth. Science 117, 528-529 (1953).
Miller, S. L. in The Molecular Origins of Life (ed Brack, A.) 59-85 (Cambridge University Press, Cambridge, 1998).
Miller, S. L. & Urey, H. C. Organic compound synthesis on the primitive Earth. Science 130, 245-251 (1959).
Mirkin, B. G., Fenner, T. I., Galperin, M. Y. & Koonin, E. V. Algorithms for computing parsimonious evolutionary scenarios for
genome evolution, the last universal common ancestor and dominance of horizontal gene transfer in the evolution of prokaryotes.
BMC Evol. Biol. 3, 2 (2003).
�{��L �����̋N���ƌ��n�n���̉��x. Viva Origino 32, 81-95 (2004).
Miyakawa, S., Murasawa, K., Kobayashi, K. & Sawaoka, A. B. Cytosine and urasil synthesis by quenching with high-temperature plasma.
J. Am. Chem. Soc. 121, 8144-8145 (1999a).
Miyakawa, S., Sawaoka, A. B., Ushio, K. & Kobayashi, K. Mechanisms of amino acid formation using optical emission spectroscopy.
J. Appl. Phys. 85, 6853-6857 (1999b).
Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J. & Miller, S. L. Prebiotic synthesis from CO atmospheres:
Implications for the origins of life. Proc. Natl. Acad. Sci. USA 99, 14628-14631 (2002).
Miyazaki, J. et al. Ancestral residues stabilizing 3-isopropylmalate dehydrogenase of an extreme thermophile:
Experimental evidence supporting the thermophilic common ancestor hypothesis. J. Biochem. 129, 777-782 (2001).
Mojzsis, S. J. et al. Evidence for life on Earth before 3,800 million years ago. Nature 384, 55-59
(1996).
Mojzsis, S. J., Harrison, T. M. & Pidgeon, R. T. Oxygen-isotope evidence from ancient zircons for liquid water at the
Earth's surface 4,300 Myr ago. Nature 409, 178-181 (2001).
Mojzsis, S. J. & Harrison, T. M. Origin and significance of Archean quartzose rocks at Akilia, Greenland. Science
298, 917a (2002).
Mojzsis, S. J., Krishnamurthy, R. & Arrhenius, G. in The RNA World 2nd ed.
(eds Gesteland, R. F., Cech, T. R. & Atkins, J. F.) 1-47 (Cold Spring Harbor Laboratory Press, New York, 1999).
Moorbath, S. Dating earliest life. Nature 434, 155 (2005a).
Moorbath, S. Oldest rocks, earliest life, heaviest impacts, and the Hadean-Archaean transition. Appl. Geochem.
20, 819-824 (2005b).
Mulkidjanian, A. Y. et al. The cyanobacterial genome core and the origin of photosynthesis.
Proc. Natl. Acad. Sci. USA 103, 13126-13131 (2006).
Müller, D. et al. Aldomerisierung von Glycolaldehyd-phophat zu racemischen Hexose-2,4,6-triphosphaten und
(in Gegenwart von Formaldehyd) racemischen Pentose-2,4,-diphosphaten: rac-Allose-2,4,6-triphosphat und
rac-Ribose-2,4-diphosphat sind die Reaktionshauptprodukte. Helv. Chim. Acta 73, 1410-1468 (1990).
Muños Carlo, G. M. et al. Amino acids from ultraviolet irradiation of interstellar ice analogues.
Nature 416, 403-406 (2002).
Nakabachi, A. et al. The 160-kilobase genome of the bacterial endosymbiont Carsonella.
Science 313, 267 (2006).
Nakamura-Messenger, K., Messenger, S., Keller, L. P., Clemett, S. J. & Zolensky, M. E. Organic globules
in the Tagish Lake meteorite: Remnants of the protosolar disk. Science 314, 1439-1442 (2006).
Nielsen, P. E., Egholm, M., Berg, R. H. & Buchardt, O. Sequence-selective recognition of DNA by strand displacement
with a thymidine-substituted polyamide. Science 254, 1497-1500 (1991).
Nisbet, E. G. & Sleep, N. H. The habitat and nature of early life. Nature 409, 1083-1091 (2001).
Nissen, P., Hansen, J., Ban, N., Moore, P. B. & Steitz, T. A. The structural basis of ribosome activity
in peptide bond synthesis. Science 289, 920-930 (2000).
Noller, H. F., Hoffarth, V. & Zimniak, L. Unusual resistance of peptidyl transferase to protein extraction procedures.
Science 256, 1416-1419 (1992).
Noorduin, W. L. et al. Emergence of a single solid chiral state from a nearly racemic amino acid derivative.
J. Am. Chem. Soc. 130, 1158-1159 (2008).
Nutman, A. P. Comment on "zircon thermometer reveals minimum melting conditions on earliest Earth" II.
Science 311, 779b (2006).
Oba, T., Fukushima, J., Maruyama, M., Iwamoto, R. & Ikehara, K. Catalytic activities of [GADV]-peptides.
Orig. Life Evol. Biosph. 34, 447-460 (2005).
Oberbeck, V. R. & Fogleman, G. Impacts and the origin of life. Nature 339, 434 (1989).
Oliver, J. D. & Perry, R. S. Definitely life but not definitively.
Orig. Life Evol. Biosph. 36. 515-521 (2006).
Orgel, L. E. The origin of polynucleotide-directed protein synthesis. J. Mol. Evol. 29, 456-474 (1989).
Oró, J. Synthesis of adenine from ammonium cyanide. Biochem. Biophys. Res. Commun. 2, 407-412 (1960).
Oró, J. Comets and the formation of biochemical compounds on the primitive Earth.
Nature 190, 389-390 (1961).
Osawa, S. Evolution of the Genetic Code (Oxford University Press, Oxford, 1995).
Owen, T. C. in The Molecular Origins of Life (ed Brack, A.) 13-34 (Cambridge University Press, Cambridge, 1998).
Pasteris, J. D. & Wopenla, B. Images of the Earth's earliest fossils? Nature 420, 476-477 (2002).
Paul, N. & Joyce, G. F. A self-replicating ligase ribozyme. Proc. Natl. Acad. Sci. USA
99, 12733-12740 (2002).
Peretó, J., López-García, P. & Moreira, D. Ancestral lipid biosynthesis and early membrane evolution.
Trends Bioche. Sci. 29, 469-477 (2004).
Ponnanmperuma, C. & Mariner, R. The formation of ribose and deoxyribose by ultraviolet irradiation of formaldehyde in water.
Radiation Res. 19, 183 (1963).
Ranea, J. A. G., Sillero, A., Thornton, J. M. & Orengo, C. A. Protein superfamily evolution and the last universal common ancestor (LUCA).
J. Mol. Evol. 63, 513-525 (2006).
Rasmussen, B. Filamentous microfossils in a 3,235-million-year-old volcanogenic massive sulphide deposit.
Nature 405, 676-679 (2000).
Reader, J. S. & Joyce, G. F. A ribozyme composed of only two different nucleotides. Nature 420,
841-844 (2002).
Reid, C. & Orgel, L. E. Synthesis of sugars in potentially prebiotic conditions. Nature 216, 455 (1967).
Ricardo, A., Carrigan, M. A., Olcott, A. N. & Benner, S. A. Borate minerals stabilize ribose.
Science 303, 196 (2004).
Rivera, M. C. & Lake, J. A. The ring of life provides evidence for a genome fusion origin of eukaryotes.
Nature 431, 152-155 (2004).
Robert, F. & Chaussidon, M. A palaeotemperature curve for the Precambrian oceans based on silicon isotopes in cherts.
Nature 443, 969-972 (2006).
Robertson, M. P. & Miller, S. L. An efficient prebiotic synthesis of cytosine and uracil.
Nature 375, 772-774 (1995).
Robertson, M. P. & Scott, W. G. The structural basis of ribozyme-catalyzed RNA assembly. Science 315,
1549-1553 (2007).
Rogers, J. & Joyce, G. F. The effect of cytidine on the structure and function of an RNA ligase ribozyme.
RNA 7, 395-404 (2001).
Rosing, M. T. 13C-depleted carbon microparticles in >3700-Ma sea-floor sedimentary rocks from west Greenland.
Science 283, 674-676 (1999).
Rosing, M. T. & Frei, R. U-rich Archaean sea-floor sediments from Greenland - indications of >3700 Ma oxygenic photosynthesis.
Earth Planet. Sci. Lett. 217, 237-244 (2004).
Ruiz-Mirazo, K., Peretó, J. & Moreno, A. A universal definition of life: autonomy and open-ended evolution.
Orig. Life Evol. Biosph. 34, 323-346 (2004).
Sagan, C. & Chyba, C. The early faint Sun paradox: Organic shielding of ultraviolet-labile greenhouse gases. Science
276, 1217-1221 (1997).
Saito, H., Kourouklis, D. & Suga, H. An in vitro evolved precursor tRNA with aminoacylation activity.
EMBO J. 20, 1797-1806 (2001).
�ē����p, �n�ӌ��j ����� ���T�� �����Ǔ����q�i���@��p���Đ����̋N����T��. �`�����j�_�y�f 47, 1209-1214 (2002).
�ē��� ���̍\�����q�̐����Ƃ��̔�Ώ̐��̋N��. ��`�ʍ� 12, 52-60 (2000).
Sanchez, R. A., Ferris, J. P. & Orgel, L. E. Cyanoacetylene in prebiotic synthesis. Science 154, 784-785 (1966).
Sandford, S. A. et al. Organics captured from comet 81P/Wild 2 by the Stardust spacecraft.
Science 314, 1720-1724 (2006).
���G�� ����� �ΐ_���_ in �u���i���D�����̒a�� (eds �ĒJ�čO, ����h ����� �{�V�Ўi) 93-122
(������w�o�ʼn�, ����, 1991).
Sawai, H., Lohrmann, R. & Orgel, L. E. Prebiotic peptide-formation in the solid state. J. Mol. Evol. 6,
165-184 (1975).
Schidlowski, M. A 3,800-million-year isotopic record of life from carbon in sedimentary rocks. Nature 333,
313-318 (1988).
Schlesinger, G. & Miller, S. L. Prebiotic synthesis in atmospheres containing CH4, CO, and CO2
I. Amino acids. J. Mol. Evol. 19, 376-382 (1983).
Schoenberg, R., Kamber, B. S., Collerson, K. D. & Moorbath, S. Tungsten isotope evidence from ∼3.8-Gyr metamorphosed
sediments for early meteorite bombardment of the Earth. Nature 418, 403-405 (2002a).
Schoenberg, R., Kamber, B. S., Collerson, K. D. & Eugster, O. New W-isotope evidence for rapid terrestrial accretion and
very early core formation. Geochim. Cosmochim. Acta 66, 3151-3160 (2002b).
Schopf, J. W. & Packer, B. M. Early Archean (3.3-billion to 3.5-billion-year-old) microfossils from Warrawoona Group,
Australia. Science 237, 70-73 (1987).
Schopf, J. W. in The Proterozoic Biosphere: a Multidisciplinary Study (eds Schopf, J. W. & Klein, C.) 25-39
(Cambridge University Press, Cambridge, 1992).
Schopf, J. W. Microfossils of the Early Archean Apex chert: new evidence of the antiquity of life. Science
260, 640-646 (1993).
Schopf, J. W. Cradle of Life: the Discovery of Earth's Earliest Fossils (Prinston University Press, New Jersey, 1999).
Schopf, J. W. Laser-Raman imagery of Earth's earliest fossils. Nature 416, 73-76 (2002a).
Schopf, J. W. et al. Images of the Earth's earliest fossils? Nature 420, 477 (2002b).
Schwartz, A. W. & de Graaf, R. M. The prebiotic synthesis of carbohydrates: A reassessment.
J. Mol. Evol. 36, 101-106 (1993).
Schwartz, A. W. & Goverde, M. Acceleration of HCN oligomerization by formaldehyde and related compounds:
Implications for prebiotic synthesis. J. Mol. Evol. 18, 351-353 (1982).
Schwartz, A. W., Voet, A. B. & Van Der Veen, M. Recent progress in the prebiotic chemistry of HCN.
Orig. Life 14, 91-98 (1984).
Seljak, U. et al. Cosmological parameter analysis including SDSS Lyα forest and galaxy bias:
Constraints on the primordial spectrum of fluctuations, neutrino mass, and dark energy. Phys. Rev. D 71, 103515
(2005).
Shapiro, R. Prebiotic ribose synthesis: A critical analysis. Orig. Life Evol. Biosph. 18, 71-85 (1988).
Shatalkin, A. I. Highet level of division in classification of organisms. 3. Monodermata and Didermata.
Zh. Obshch. Biol. 65, 195-210 (2004).
Shen, Y., Buick, R. & Canfield, D. E. Isotopic evidence for microbial sulphate reduction in the early Archaean era.
Nature 410, 77-81 (2001).
Sherwood Lollar, B. & McCollom, T. M. Biosignatures and abiotic constraints on early life.
Nature 444, E18 (2006).
Shimizu, M. Specific aminoacylation of C4N hairpin RNAs with the cognate aminoacyl-adenylates in the presence of a dipeptide:
Origin of the genetic code. J. Biochem. 117, 23-26 (1995).
�������v �����̖{���ƋN�� (�����o��, ����, 1996).
Silber, R., Malathi, V. G. & Hurwitz, J. Purification and properties of bacteriophage T4-induced RNA ligase.
Proc. Natl. Acad. Sci. USA 69, 3009-3013 (1972).
Sleep, N. H., Zahnle, K. J., Kasting, J. F. & Morowitz, H. J. Annihilation of ecosystems by large asteroid impacts on the early
Earth. Nature 342, 139-142 (1989).
Spergel, D. N. et al. First-year Wilkinson Microwave Anisotropy Probe (WMAP) observations: determination of
cosmological parameters. Astrophys. J. Suppl. 148, 175-194 (2003).
Spergel, D. N. et al. Three-year Wilkinson Microwave Anisotropy Probe (WMAP) observations:
Implications for cosmology. Astrophys. J. Suppl. 170, 377- 408 (2007).
Stetter, K. O. in The Molecular Origins of Life (ed Brack, A.) 315-335 (Cambridge University Press, Cambridge, 1998).
Stoks, P. G. & Sanchez, A. W. Uracil in carbonaceous meteorites. Nature 282, 709-710 (1979).
Stoks, P. G. & Sanchez, A. W. Nitrogen-heterocyclic compounds in meteorites: Significance and mechanisms of formation.
Geochim. Cosmochim. Acta 45, 563-569 (1981).
Strobel, S. A. Repopulationg the RNA world. Nature 411, 1003-1006 (2001).
Strom, R. G., Malhotra, R., Ito, T., Yoshida, F. & Kring, D. A. The origin of planetary impactors in the inner solar system.
Science 309, 1847-1850 (2005).
Szabo, P., Scheuring, I., Czaran, T. & Szathmary, E. In silico simulations reveal that replicators
with limited dispersal evolve towards higher efficiency and fidelity. Nature 420, 340-343 (2002).
Szostak, J. W., Bartel, D. P. & Luisi, P. L. Synthesizing life. Nature 409, 387-390 (2001).
Takahashi, J. et al. Abiotic synthesis of amino acids by x-ray irradiation of simple inorganic gases.
Appl. Phys. Lett. 74, 877-879 (1999).
Takai, K. & Horikoshi, K. Genetic diversity of Archaea in deep-sea hydrothermal environments.
Genetics 152, 1285-1297 (1999).
Tegmark, M. et al. Cosmological parameters from SDSS and WMAP. Phys. Rev. D 69, 103501 (2004).
Tegmark, M. et al. Cosmological constraints from the SDSS luminous red galaxies. Phys. Rev. D 74, 123507
(2006).
Tera, F., Papanastassiou, D. A. & Wasserburg, G. J. Isotopic evidence for a terminal lunar cataclysm. Earth Planet. Sci.
Lett. 22, 1-21 (1974).
Tian, F., Toon, O. B., Pavlov, A. A. & De Sterck, H. A hydrogen-rich early Earth atmosphere. Science 308,
1014-1017 (2005).
Tian, F., Toon, O. B. & Pavlov, A. A. Response to comment on "a hydrogen-rich early Earth atmosphere".
Science 311, 38b (2006).
Tice, M. M. & Lowe, D. R. Photosynthetic microbial mats in the 3,416-Myr-old ocean. Nature 431, 549-552 (2004).
Tsiganis, K., Gomes, R., Morbidelli, A. & Levison, H. F. Origin of the orbital architecture of the giant planets of the Solar
System. Nature 435, 459-461 (2005).
Ueno, Y., Maruyama, S., Isozaki, Y. & Yurimoto, H. in Geochemistry and the Origin of Life (eds Nakashima, S.,
Maruyama, S., Brack, A. & Windley, B. F.) 203-236 (Universal Academy Press, Tokyo, 2001).
Ueno, Y., Yamada, K., Yoshida, N., Maruyama, S. & Isozaki, Y. Evidence from fluid inclusions for microbial
methanogenesis in the early Archaean era. Nature 440, 516-519 (2006a).
Ueno, Y., Yamada, K., Yoshida, N., Maruyama, S. & Isozaki, Y. Ueno et al. reply. Replying to:
B. Sherwood Lollar & T. M. McCollom Nature 444, doi: 10.1038/nature05499 (2006).
Nature 444, E18-E19 (2006b).
van Zuilen, M. A., Lepland, A. & Arrhenius, G. Reassessing the evidence for the earliest traces of life. Nature
418, 627-630 (2002).
Vlassov, A. V., Kazakov, S. A., Johnston, B. H. & Landweber, L. F. The RNA world on ice:
A new scenario for the emergence of RNA information. J. Mol. Evol. 61, 264-273 (2005).
Watson, E. B. & Harrison, T. M. Zircon thermometer reveals minimum melting conditions on earliest Earth. Science 308,
841-844 (2005).
Watson, E. B. & Harrison, T. M. Response to Comments on "zircon thermometer reveals minimum melting conditions on earliest Earth".
Science 311, 779c (2006).
Weber, A. L. & Miller, S. L. Reasons for the occurrence of the twenty coded protein amino acids. J. Mol. Evol.
17, 273-284 (1981).
Weiner, A. M. & Maizels, N. tRNA-like structures tag the 3' ends of genomic RNA molecules for replication:
Implications for the origin of protein synthesis. Proc. Natl. Acad. Sci. USA 84, 7383-7387 (1987).
Weiner, A. M. Eukaryotic nuclear telomerase: Molecular fossils of the RNP world? Cell 52, 155-157 (1988).
Weiss, B. P. et al. A low temperature transfer of ALH84001 from Mars to Earth. Science
290, 791-795 (2000).
Wilde, S. A., Valley, J. W., Peck, W. H. & Grahams, C. M. Evidence from detrital zircons for the existence of continental
crust and oceans on the Earth 4.4 Gyr ago. Nature 409, 175-178 (2001).
Wittung, P., Nielsen, P. E., Buchardt, O., Egholm, M. & Nordén, B. DNA-like double helix formed by peptide nucleic acid.
Nature 368, 561-563 (1994).
Woese, C. R. & Fox, G. E. Phylogenetic structure of the prokaryotic domain: The primary kingdoms.
Proc. Natl. Acad. Sci. USA 74, 5088-5090 (1977).
Woese, C. R., Kandler, O. & Wheelis, M. L. Towards a natural system of organisms: Proposal for the domains Archaea, Bacteria, and Eucarya.
Proc. Natl. Acad. Sci. USA 87, 4576-4579 (1990).
Woese, C. R. On the evolution of cells. Proc. Natl. Acad. Sci. USA 99, 8742-8747 (2002).
Wong, J. T.-F. Evolution of the genetic code. Microbiol. Sci. 5, 174-181 (1988).
Yamagata, Y., Watanabe, H., Saitoh, M. & Namba, T. Volcanic production of polyphosphates
and its relevance to prebiotic evolution. Nature 352, 516-519 (1991).
�R�ݖ��F �S�����̋��ʂ̑c��̎����I����: �ߋ��̃^���p�N�����Č�����. �n�w�G�� 112, 197-207 (2003).
����O�u ������ RNA ����n�܂��� (��g���X, ����, 1994).
����O�u �����͔M���n�Ŏn�܂����̂��H �Ȋw 66, 461-463 (1996).
Yanagawa, H. & Egami, F. Marigranules from glycine and acidic, basic, and aromatic amino acids in a modified sea medium.
Proc. Japan Acad. Ser. B 54, 10-14 (1978).
Yanagawa, H., Kobayashi, K. & Egami, F. Characterization of marigranules and marisomes, organized particles with elastin-like
structures. J. Biochem 87, 855-869 (1980).
����O�u ����� ���ь��� �����̋N���̏�Ƃ��Ă̊C��M�����o�E. �n�����w 22, 96-105 (1988).
Yanagawa, H. & Kobayashi, K. An experimental approach to chemical evolution in submarine hydrothermal systems.
Orig. Life Evol. Biosph. 22, 147-159 (1992).
Yanagawa, H. & Kojima, K. Thermophilic microspheres of peptide-like polymers and silicates formed at 250°C.
J. Biochem 97, 1521-1524 (1985).
Yanagawa, H., Ogawa, Y., Kojima, K. & Ito, M. Construction of protocellular structures under simulated primitive earth conditions.
Orig. Life Evol. Biosph. 18, 179-207 (1988).
Yin, Q. et al. A short timescale for terrestrial planet formation from Hf-W chronometry of meteorites. Nature
418, 949-952 (2002).
Zepik, H. et al. Chiral amplification of oligopeptides in two-dimensional crystalline self-assemblies on water.
Science 295, 1266-1269 (2002).
Zhang, B. & Cech, T. R. Peptide bond formation by in vitro selected ribozymes.
Nature 390, 96-100 (1997).